Dein Leid ist mein Leid? Wie wir die Emotionen anderer Personen nachempfinden.
Empathie spielt eine bedeutende Rolle in unseren alltäglichen, zwischenmenschlichen Beziehungen. Neurowissenschaftliche und psychologische Forschung versucht daher, die Grundlagen von Empathie im Gehirn zu verstehen. Dafür wird oft die Schmerzwahrnehmung herangezogen. Was passiert in unserem Gehirn, wenn wir beobachten, wie eine andere Person Schmerzen empfindet? Inwiefern spielt unser eigenes Schmerzerleben dabei eine Rolle? Welchen Einfluss hat die Einnahme von Medikamenten auf unsere empathischen Fähigkeiten? Und ist Empathie bei psychischen Beeinträchtigungen, wie Depression oder Autismus, tatsächlich eingeschränkt?
Stellen Sie sich folgende Situation vor: Jemand holt Sie zum Mittagessen ab, schlägt sich dabei unabsichtlich den Ellbogen am Türrahmen an und reibt sich mit schmerzverzerrtem Gesicht den Arm. Beim Beobachten eines solchen Ereignisses zieht sich sofort alles innerlich zusammen und man bekommt ein komisches Gefühl. Eventuell fühlt man sogar ein unangenehmes Kribbeln bis hin zu so etwas wie Schmerzen im eigenen Ellbogen. Solche Situationen kommen im Alltag ständig vor, wir bemerken unsere Reaktionen darauf aber oft nicht bewusst. Das ist überraschend, da diese eine wichtige Funktion haben und uns erlauben, mit unserer sozialen Umwelt zu interagieren. Aber wie und warum spüren wir den Schmerz Anderer? Und wie können wir adäquat darauf reagieren?
Das Nachempfinden und Verstehen der Emotionen anderer Personen wird als Empathie bezeichnet (Lamm, 2019). Wörtlich übersetzt bedeutet Empathie Einfühlen in bzw. Fühlen mit andere(n). In der Forschung umfasst Empathie dagegen als psychologisches Konstrukt mehrere zusammenspielende Teile: Zunächst beobachten wir eine Emotion bei jemandem in der Realität oder den Medien. Dafür reicht es auch oft, sich die Emotion nur vorzustellen. So entsteht ein rasches, automatisches Teilen dieses Gefühlszustandes – wir fühlen also recht unmittelbar, aber auch eher grob das, was die andere Person gerade fühlt. Für die darauffolgende kognitive Verarbeitung der Emotion kommen unsere Fähigkeiten zur Perspektivenübernahme sowie zur Abgrenzung zwischen uns selbst und anderen zum Einsatz (Stietz et al., 2019). Sie ordnen das Nachempfinden etwas genauer ein, können es also z. B. noch verstärken, aber auch abschwächen. Mithilfe dieser Mechanismen können wir adäquat kategorisieren, dass die Gefühle, die wir empfinden von der anderen Person ausgehen und nicht von uns selbst. Für das Entstehen von Empathie ist also sowohl die affektive als auch die kognitive Verarbeitung der geteilten Emotion notwendig und wichtig.
 Bild 1: Empathie, umgangssprachlich auch Mitleid oder Mitgefühl genannt, bezeichnet das Teilen und Verstehen der Emotionen anderer Personen. Wir fühlen also genau das, was eine andere Person gerade fühlt.
Bild 1: Empathie, umgangssprachlich auch Mitleid oder Mitgefühl genannt, bezeichnet das Teilen und Verstehen der Emotionen anderer Personen. Wir fühlen also genau das, was eine andere Person gerade fühlt.
Empathie ≠ Mitgefühl, Emotionsansteckung, oder Emotionserkennung
Umgangssprachlich wird Empathie oft Mitgefühl oder Mitleid genannt. Bei Letzteren handelt es sich jedoch um verwandte Phänomene, bei denen Teilaspekte (z. B. die Sorge um einen Menschen) oder andere Konzepte im Vordergrund stehen. Empathie sollte daher von verschiedenen, verwandten Prozessen unterschieden werden.
Wenn wir jemanden sehen, der sich verletzt, reagieren wir meist automatisch darauf, wie im Beispiel oben. Das gilt auch für positive Emotionen – so lächeln wir, wenn jemand anderer sich freut. Das nennt man Gefühlsansteckung, also die automatische Auslösung von Emotionen durch die Beobachtung von Emotionen und deren Ausdruck bei einer anderen Person. Diese wird oft als Vorläufer von Empathie gesehen. Wenn wir nun den Ursprung dieser automatisch entstandenen Emotion nicht in der anderen Person verorten, kann es zu einer Überwältigung durch eigene Gefühle kommen. Eine selbst-fokussierte, negative emotionale Reaktion wie Angst oder Unbehagen folgt. Bei Mitgefühl oder auch empathischer Anteilnahme fühlen wir dagegen nicht nur mit der anderen Person, sondern auch für sie, sorgen uns also etwa um ihr Wohlbefinden. Zudem müssen wir Emotionen nicht unbedingt nachempfinden, um sie nachvollziehen zu können. Dafür gibt es einen anderen kognitiven Mechanismus, die Fähigkeit mentale Zustände anderer zu identifizieren oder zu verstehen. Dieser wird allgemein als Theory of Mind, Perspektivenübernahme oder Mentalisieren bezeichnet (Schurz et al., 2020), und in Bezug auf Emotionen oft mit Emotionsidentifikation in Verbindung gebracht (Coll et al., 2017).
Aber welche Konsequenzen hat Empathie eigentlich für unsere alltäglichen sozialen Interaktionen? Mehrere Studien belegen inzwischen einen positiven Zusammenhang zwischen Empathie und späterem helfendem Verhalten gegenüber Anderen (Decety et al., 2016). Auf Empathie sowie Anteilnahme kann somit prosoziales Verhalten folgen, also helfende Verhaltensweisen wie körperliche Nähe, Zuspruch oder Hilfe holen. Zugleich können empathisch wahrgenommene Emotionen aber auch zu Rückzug (um sich selbst vor negativen Gefühlen zu schützen) oder gar zu antisozialen Verhaltensweisen wie Aggression führen (Bloom, 2017). Letzteres kann beispielsweise bei der Fehlinterpretation der Emotionen einer anderen Person geschehen.
Empathie durch Reaktivierung eigener Emotionen
Bei der neurowissenschaftlichen Erforschung von
Empathie wird physischer Schmerz gerne als Modell herangezogen, u. a. weil dieser in psychologischen Experimenten einfach und gut kontrollierbar wiederholt verabreicht werden kann. Ein 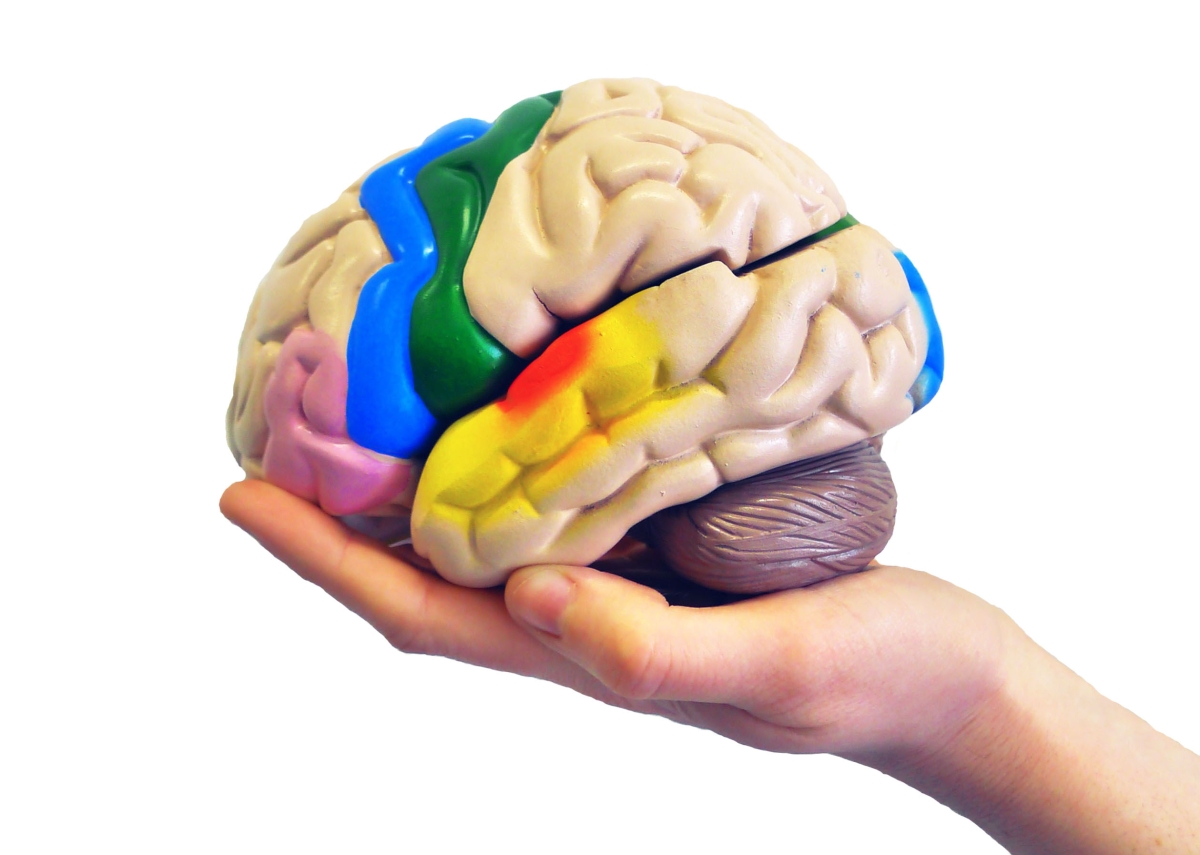 Bild 2: Neurowissenschaftliche Forschung zeigt, dass unser Gehirn Empathie für den Schmerz anderer Personen in bestimmten Regionen verarbeitet, die Teil unseres körpereigenen Schmerznetzwerks sind. Dazu zählen unter anderem der anteriore insuläre und vordere mittlere zinguläre Kortex, die beide dem sogenannten affektiv-motivationalen Teil von Schmerzwahrnehmung zugeschrieben werden. Der sensorisch-diskriminative Teil umfasst dagegen den primären und sekundären somatosensorischen Kortex.schmerzhafter Reiz fühlt sich für die meisten auch bei mehrmaliger Wiederholung schmerzhaft an, ohne dass es zu starken Gewöhnungseffekten kommt, die hingegen bei Emotionen oft auftreten können. Zudem sind die Grundlagen der Schmerzwahrnehmung im Gehirn bereits sehr gut erforscht und somit dazu geeignet, auf ihnen aufbauend
Empathie zu untersuchen.
Bild 2: Neurowissenschaftliche Forschung zeigt, dass unser Gehirn Empathie für den Schmerz anderer Personen in bestimmten Regionen verarbeitet, die Teil unseres körpereigenen Schmerznetzwerks sind. Dazu zählen unter anderem der anteriore insuläre und vordere mittlere zinguläre Kortex, die beide dem sogenannten affektiv-motivationalen Teil von Schmerzwahrnehmung zugeschrieben werden. Der sensorisch-diskriminative Teil umfasst dagegen den primären und sekundären somatosensorischen Kortex.schmerzhafter Reiz fühlt sich für die meisten auch bei mehrmaliger Wiederholung schmerzhaft an, ohne dass es zu starken Gewöhnungseffekten kommt, die hingegen bei Emotionen oft auftreten können. Zudem sind die Grundlagen der Schmerzwahrnehmung im Gehirn bereits sehr gut erforscht und somit dazu geeignet, auf ihnen aufbauend
Empathie zu untersuchen.
Das körpereigene Schmerznetzwerk im Gehirn kann grob in zwei Teile gegliedert werden: Der sensorische Teil arbeitet auf Hochtouren, um uns Informationen zur grundlegenden physischen Qualität des Schmerzes zu liefern, wie dessen Entstehungsort (Ellbogen), Art (stechend, kribbelnd) und Dauer (Sekunden). Der affektive Teil erfasst dagegen, wie subjektiv unangenehm der Schmerz ist und was getan werden muss, um ihn schnellstmöglich abzustellen. Beide Teile kreieren zusammen ein individuell verschiedenes sowie stark situationsabhängiges Schmerzerlebnis.
Jetzt wird es spannend: Zahlreiche wissenschaftliche Studien haben mittels neurowissenschaftlicher Methoden herausgefunden, dass im Gehirn überlappende, d. h. ähnliche Bereiche aktiv sind, wenn wir selber Schmerz empfinden und wenn wir beobachten, wie jemand anders Schmerz empfindet (Timmers et al., 2018). Mittels funktioneller Magnetresonanztomographie oder Elektroenzephalographie wird dabei die Gehirnaktivität gemessen, entweder während Versuchspersonen selber Schmerz spüren, z. B. indem sie schmerzhafte elektrische Reize verabreicht bekommen, oder aber beobachten, wie eine andere Person solche Reize erhält.
Empathie für Schmerz wird also teilweise in jenem Gehirn-Netzwerk verarbeitet, das auch in die körpereigene Schmerzwahrnehmung eingebunden ist (Lamm et al., 2011). Solche Ergebnisse sind im Einklang mit dem
Ansatz der geteilten Repräsentationen sowie mit simulationstheoretischen Ansätzen. Diese besagen, dass das Nachempfinden von Emotionen anderer Personen neuronale Prozesse im Gehirn aktiviert, die teilweise auch beim eigenen Fühlen dieser Emotionen rekrutiert werden (Lamm et al., 2019). In anderen Worten reaktivieren und nutzen wir unser eigenes Emotionsverarbeitungssystem, um die Emotionen Anderer nachzubilden (zu „simulieren“). Dadurch können wir diese Emotionen unmittelbar körperlich und qualitativ nachempfinden – eben weil wir die Repräsentation der Emotionen teilen und dadurch erfahrungsgeleiteter verstehen, wie sich die andere Person fühlt.  Bild 3: Die Beobachtung oder Vorstellung von anderen Personen in schmerzhaften Situationen löst in uns eine empathische Reaktion aus, die ein Verstehen und Teilen dieses Schmerzes umfasst.
Bild 3: Die Beobachtung oder Vorstellung von anderen Personen in schmerzhaften Situationen löst in uns eine empathische Reaktion aus, die ein Verstehen und Teilen dieses Schmerzes umfasst.
Verringert sich durch die Gabe von Schmerzmedikamente unsere Empathie?
Diese oben erwähnten Studien erklären jedoch lediglich Zusammenhänge zwischen dem Auftreten von Empathie und den begleitenden neuronalen Aktivitäten. Sie zeigen noch nicht, ob in beiden Situationen tatsächlich dieselben mentalen Prozesse greifen und damit auch exakt die gleichen Nervenzellen aktiv sind. Dafür benötigt es präzisere Experimente, die Aussagen über Ursache-Wirkungs-Beziehungen machen können.
Wir haben daher in mehreren Studien untersucht, wie sehr unser eigenes Schmerzerleben tatsächlich beteiligt ist, wenn wir Empathie empfinden (Rütgen et al., 2015). Der Gedankengang dabei: Wenn eigener Schmerz und Empathie für Schmerz auf den gleichen grundlegenden Funktionen und Mechanismen im Gehirn beruhen, sollte die experimentelle Veränderung des eigenen Schmerzempfindens auch Einfluss darauf haben, wie empathisch wir auf den Schmerz einer anderen Person reagieren. Dafür wurde das Phänomen der Placebo Analgesie, eine Schmerzverringerung durch Gabe eines Scheinmedikaments, eingesetzt. Konkret bekam die Hälfte der Versuchspersonen eine Pille, die als wirkungsvolles Schmerzmedikament vorgestellt wurde, in Wahrheit aber keine aktiven Wirkstoffe enthielt (Placebogruppe). Allein durch die damit verbundene Erwartung und Überzeugung, ein echtes Schmerzmittel eingenommen zu haben, werden körpereigene Opiate, sogenannte Endorphine, ausgeschüttet, welche in Folge zu einer Schmerzverringerung führen (siehe auch Endogenes Opioidsystem). Die Kontrollgruppe erhielt dagegen keine Pille. Im eigentlichen Experiment bekamen zwei Versuchspersonen abwechselnd schmerzhafte elektrische Reize verabreicht. Wie erwartet zeigte die Placebogruppe im Vergleich zur Kontrollgruppe nicht nur eine Verringerung des eigenen Schmerzes, sondern auch weniger Empathie für den Schmerz der zweiten Versuchsperson. Dies war nicht nur in den subjektiven Bewertungen mittels einer Schmerz-Skala zu erkennen, sondern auch im Gehirn: Das Netzwerk, welches mit Schmerz und Schmerzempathie assoziiert wird, war bei Versuchspersonen der Placebogruppe sowohl bei selbst empfundenem als auch bei empathischem Schmerz weniger stark aktiviert als bei Versuchspersonen der Kontrollgruppe.
Interessanterweise konnten in einer Folgestudie (Rütgen et al., 2021) die beschriebenen Effekte der Schmerzverringerung nicht nur in Bezug auf Schmerzempathie beobachtet werden, sondern auch für andere negative Emotionen, wie etwa die Verarbeitung unangenehmer Berührungen bei anderen Personen (mit Maden, Schnecken oder Spinnen). Es ist also möglich, dass Schmerzmedikamente nicht nur Schmerz, sondern allgemein negative Gefühlszustände beeinflussen. Damit im Einklang zeigte eine weiterführende Untersuchung, dass das Teilen des Schmerzes Anderer hauptsächlich auf dem affektiven und weniger auf dem sensorischen Teil der Empathie beruht (Hartmann et al., 2021). In dieser Studie führte ein Placebo-Schmerzgel auf der Hand der Versuchspersonen, welches den Fokus auf den genauen Ort des Schmerzes und damit auf sensorische Aspekte von Empathie legte, nicht zu spezifisch verringerter Empathie für diesen Körperteil bei einer anderen Person. Wir konzentrieren uns beim Empfinden von Empathie also möglicherweise eher auf das generelle, unangenehme Gefühl des Schmerzes der anderen Person, anstatt auf den genauen Ort im Körper, wo dieser ausgelöst wird.
Mit anderen Worten legen die aufgeführten Befunde nahe, dass die eigene (körperliche oder emotionale) Ausgangslage einen starken Einfluss auf unsere Empathie hat. Dieser Umstand ist insbesondere bei psychiatrischen Erkrankungen sehr relevant, da sich diese oft durch verändertes emotionales Erleben auszeichnen.
Empathie bei psychischen Erkrankungen
Wie ist die Forschungslage bei psychischen Erkrankungen, in denen beeinträchtigte sozio-emotionale Fähigkeiten Teil der Symptome sind? Bisher wurde angenommen, dass bei Personen mit akuter
Depression das empathische Einfühlungsvermögen eingeschränkt ist. Eine Studie legt jedoch nahe, dass nicht die
Depression an sich, sondern eher eingenommene
Antidepressiva zur Verringerung empathischer Reaktionen führen könnten (Rütgen et al., 2019). Hierbei wurden PatientInnen mit akuter  Bild 4: Die Einnahme von Medikamenten kann unsere Fähigkeit zur Empathie beeinflussen. Dies wurde nicht nur im Falle von Antidepressiva und Schmerzmitteln gezeigt, sondern auch bei der Einnahme von Scheinmedikamenten, sogenannten Placebos.
Depression vor und nach einer psychopharmakologischen Behandlung mit
Antidepressiva, mit einer
Kontrollgruppe ohne Vorerkrankungen verglichen. Zu beiden Messzeitpunkten schauten sich die Versuchspersonen Videos von Menschen an, die sich schmerzhaften medizinischen Eingriffen unterzogen. Vor der Behandlung fanden sich keine Unterschiede bezüglich der empathischen Reaktionen auf die Videos zwischen PatientInnen und KontrollprobandInnen. Interessanterweise gaben PatientInnen jedoch nach der Behandlung an, weniger
Empathie zu empfinden, und ihre Gehirnaktivität im Netzwerk für Schmerzempathie war im Vergleich zur
Kontrollgruppe reduziert. Diese Befunde reihen sich ein in die Ergebnisse der obig beschriebenen
Placebo-Studien ein und verdeutlichen den Einfluss von Schmerzmedikamenten und Psychopharmaka auf unsere emotionale Wahrnehmung.
Bild 4: Die Einnahme von Medikamenten kann unsere Fähigkeit zur Empathie beeinflussen. Dies wurde nicht nur im Falle von Antidepressiva und Schmerzmitteln gezeigt, sondern auch bei der Einnahme von Scheinmedikamenten, sogenannten Placebos.
Depression vor und nach einer psychopharmakologischen Behandlung mit
Antidepressiva, mit einer
Kontrollgruppe ohne Vorerkrankungen verglichen. Zu beiden Messzeitpunkten schauten sich die Versuchspersonen Videos von Menschen an, die sich schmerzhaften medizinischen Eingriffen unterzogen. Vor der Behandlung fanden sich keine Unterschiede bezüglich der empathischen Reaktionen auf die Videos zwischen PatientInnen und KontrollprobandInnen. Interessanterweise gaben PatientInnen jedoch nach der Behandlung an, weniger
Empathie zu empfinden, und ihre Gehirnaktivität im Netzwerk für Schmerzempathie war im Vergleich zur
Kontrollgruppe reduziert. Diese Befunde reihen sich ein in die Ergebnisse der obig beschriebenen
Placebo-Studien ein und verdeutlichen den Einfluss von Schmerzmedikamenten und Psychopharmaka auf unsere emotionale Wahrnehmung.
Auch bei der Autismus-Spektrum-Störung die u. a. Probleme mit wechselseitigen sozialen Interaktionen wie Blickkontakt oder Körpersprache umfasst, spielt das Thema Empathie eine große Rolle. So wurde in der Vergangenheit oft berichtet, autistische Menschen hätten gar keine Empathie. Heute differenzieren WissenschaftlerInnen zwischen spezifischen Teilaspekten sozialer Kognition, und fokussieren auf konkrete Teilbeeinträchtigungen bei Empathie und verwandten Konzepten (Dziobek & Bölte, 2011). Mittlerweile gibt es viele Studien, die intakte empathische Reaktionen bei Personen mit ASS belegen, während kognitive Aspekte wie Perspektivenübernahme und Theory of Mind diesen Personen schwerer fallen. Frühere Berichte über mangelnde Empathie können dadurch erklärt werden, dass affektive und kognitive Aspekte von Empathie voneinander abhängen, also die korrekte Identifikation der Emotion einer anderen Person nötig ist, um diese nachzuempfinden.
Eine mit der Autismus-Spektrum-Störung oft gleichzeitig auftretende Beeinträchtigung ist Alexithymie. Davon Betroffene haben Probleme damit, eigene Gefühle zu erkennen und zu beschreiben, sowie diese Gefühle von körperlichen Zuständen wie Aufregung oder Erregung zu trennen (Bird & Viding, 2014). So zeigte eine Studie, dass empathische Reaktionen auf den Schmerz Anderer durch den Grad an Alexithymie beeinflusst ist, und nicht davon, ob die Person die Diagnose Autismus-Spektrum-Störung hatte (Bird et al., 2010). In der Praxis sind Alexithymie und Autismus sowie deren Effekte aber oft schwer zu trennen, da sie meist komorbid, also gleichzeitig, auftreten.
Implikationen
Aus diesen Befunden ergeben sich wichtige Implikationen für die empathischen Fähigkeiten der vielen Menschen, die regelmäßig Schmerzmedikamente einnehmen. Dabei sollte genauer untersucht werden, inwiefern sich deren Empathie durch die Einnahme solcher Substanzen (langfristig) verändert. Hier muss in Bezug auf die mögliche Allgemeingültigkeit der beschriebenen Ergebnisse angemerkt werden, dass die meisten Befunde sich auf Schmerzempathie beziehen, wogegen Forschung in Bezug auf Empathie für andere negative oder positive Emotionen noch ausgeweitet werden sollte.
Gleichzeitig ist diese Forschung relevant für Erkrankungen des körpereigenen Schmerzsystems, wie chronischem Schmerz oder angeborener Schmerzunempfindlichkeit. Was bedeutet das konstante Fühlen von Schmerz oder die ständige Abwesenheit von Schmerz für Empathie? Wie können ÄrztInnen, TherapeutInnen oder Pflegepersonal, die täglich mit dem Leid Anderer konfrontiert sind, ihre Emotionen adäquat regulieren, um nicht überlastet zu werden? Forschungserkenntnisse könnten hier in die klinische Ausbildung einfließen, um Burnout bei medizinischem Personal vorzubeugen.
Zudem ist es bedeutsam genauer zu betrachten inwiefern unsere individuelle Tendenz, mehr oder weniger empathisch zu sein, von situationsbedingten Faktoren oder psychischen Erkrankungen beeinflusst werden kann. Hier sollte zukünftige Forschung noch mehr Fokus auf den Einfluss eingenommener Medikation legen. Interessant ist auch, wie diese beobachteten Mechanismen das pro- aber auch antisoziale Verhalten von Menschen beeinflussen. So untersuchen wir in einer aktuellen Studie, ob der Einfluss von Scheinmedikamenten sogar so weit reicht, dass er unser prosoziales Verhalten verändert. Im konkreten Fall wird das über die Bereitschaft gemessen, den Schmerz einer anderen Person durch eigene physische Anstrengung zu reduzieren.
Ausblick
Zusammenfassend bleibt, dass die Wahrnehmung des Schmerzes Anderer unmittelbar und direkt mit unserem eigenen Schmerzerleben verknüpft ist. Wir verstehen andere Personen besser, indem wir uns in sie hineinversetzen und unser eigenes Emotionssystem zu Hilfe nehmen. Wenn Sie also das nächste Mal jemanden sehen, der sich den Ellbogen am Türrahmen anschlägt, dann wissen Sie nun besser, warum Sie so reagieren, wie Sie es tun.
Bildquellen
Die drei AutorInnenbilder wurden von Lukas Lengersdorff aufgenommen.
Bild 1: geralt via pixabay (https://pixabay.com/de/illustrations/kopf-k%c3%b6pfe-gegen%c3%bcber-teil..., Lizenz: https://pixabay.com/de/service/license/).
Bild 2: Eigentum der Autorin Helena Hartmann.
BIld 3: Eigentum der Autorin Helena Hartmann.
Bild 4: stevepb via Pixabay (https://pixabay.com/de/photos/kopfschmerzen-schmerz-tabletten-1540220/, Lizenz: https://pixabay.com/de/service/license/).
Literaturverzeichnis
Bird, G., Silani, G., Brindley, R., White, S., Frith, U., & Singer, T. (2010). Empathic brain responses in insula are modulated by levels of alexithymia but not autism. Brain, 133(5), 1515–1525. https://doi.org/10.1093/brain/awq060
Bird, G., & Viding, E. (2014). The self to other model of empathy: Providing a new framework for understanding empathy impairments in psychopathy, autism, and alexithymia. Neuroscience & Biobehavioral Reviews, 47, 520–532. https://doi.org/10.1016/j.neubiorev.2014.09.021
Bloom, P. (2017). Empathy and Its Discontents. In Trends in Cognitive Sciences (Vol. 21, Issue 1, pp. 24–31). Elsevier Ltd. https://doi.org/10.1016/j.tics.2016.11.004
Coll, M.-P., Viding, E., Rütgen, M., Silani, G., Lamm, C., Catmur, C., & Bird, G. (2017). Are we really measuring empathy? Proposal for a new measurement framework. Neuroscience & Biobehavioral Reviews, 83(October), 132–139. https://doi.org/10.1016/j.neubiorev.2017.10.009
Decety, J., Bartal, I. B. A., Uzefovsky, F., & Knafo-Noam, A. (2016). Empathy as a driver of prosocial behaviour: Highly conserved neurobehavioural mechanisms across species. Philosophical Transactions of the Royal Society B: Biological Sciences, 371(1686), 20150077. https://doi.org/10.1098/rstb.2015.0077
Dziobek, I., & Bölte, S. (2011). Neuropsychologische Modelle von Autismus-Spektrum-Störungen: Behaviorale Evidenz und neuro-funktionale Korrelate. Zeitschrift Für Kinder- Und Jugendpsychiatrie Und Psychotherapie, 39(2), 79–90. https://doi.org/10.1024/1422-4917/a000094
Hartmann, H., Rütgen, M., Riva, F., & Lamm, C. (2021). Another’s pain in my brain: No evidence that placebo analgesia affects the sensory-discriminative component in empathy for pain. NeuroImage, 224, 117397. https://doi.org/https://doi.org/10.1016/j.neuroimage.2020.117397
Lamm, C. (2019). Empathie und Schmerz. In H. Bornemann-Cimenti & K. Lang-Illievich (Eds.), Schmerz im Fokus – ein bio-psycho-sozio-kulturelles Phänomen (pp. 107–116). Maudrich Verlag.
Lamm, C., Decety, J., & Singer, T. (2011). Meta-analytic evidence for common and distinct neural networks associated with directly experienced pain and empathy for pain. NeuroImage, 54(3), 2492–2502. https://doi.org/10.1016/j.neuroimage.2010.10.014
Lamm, C., Rütgen, M., & Wagner, I. C. (2019). Imaging empathy and prosocial emotions. Neuroscience Letters, 693, 49–53. https://doi.org/10.1016/j.neulet.2017.06.054
Rütgen, M., Seidel, E.-M., Silani, G., Riečanský, I., Hummer, A., Windischberger, C., Petrovic, P., & Lamm, C. (2015). Placebo analgesia and its opioidergic regulation suggest that empathy for pain is grounded in self pain. Proceedings of the National Academy of Sciences of the United States of America, 112(41), E5638–E5646. https://doi.org/10.1073/pnas.1511269112
Rütgen, M., Wirth, E.-M., Riečanský, I., Hummer, A., Windischberger, C., Petrovic, P., Silani, G., & Lamm, C. (2021). Beyond sharing unpleasant affect – evidence for pain-specific opioidergic modulation of empathy for pain. Cerebral Cortex, bhaa385. https://doi.org/10.1093/cercor/bhaa385
Rütgen, Markus, Pletti, C., Tik, M., Kraus, C., Pfabigan, D. M., Sladky, R., Klöbl, M., Woletz, M., Vanicek, T., Windischberger, C., Lanzenberger, R., & Lamm, C. (2019). Antidepressant treatment, not depression, leads to reductions in behavioral and neural responses to pain empathy. Translational Psychiatry, 9(1), 164. https://doi.org/10.1038/s41398-019-0496-4
Schurz, M., Radua, J., Tholen, M. G., Maliske, L., Margulies, D. S., Rogier, B., Sallet, J., & Kanske, P. (2020). Toward a hierarchical model of social cognition: A neuroimaging meta-analysis and integrative review of empathy and Theory of Mind. Psychological Bulletin, Advance on. https://doi.org/http://dx.doi.org/10.1037/bul0000303
Stietz, J., Jauk, E., Krach, S., & Kanske, P. (2019). Dissociating Empathy From Perspective-Taking: Evidence From Intra- and Inter-Individual Differences Research. Frontiers in Psychiatry, 10(March), 1–8. https://doi.org/10.3389/fpsyt.2019.00126
Timmers, I., Park, A. L., Fischer, M. D., Kronman, C. A., Heathcote, L. C., Hernandez, J. M., & Simons, L. E. (2018). Is empathy for pain unique in its neural correlates? A meta-analysis of neuroimaging studies of empathy. Frontiers in Behavioral Neuroscience, 12(November), 289. https://doi.org/10.3389/FNBEH.2018.00289



